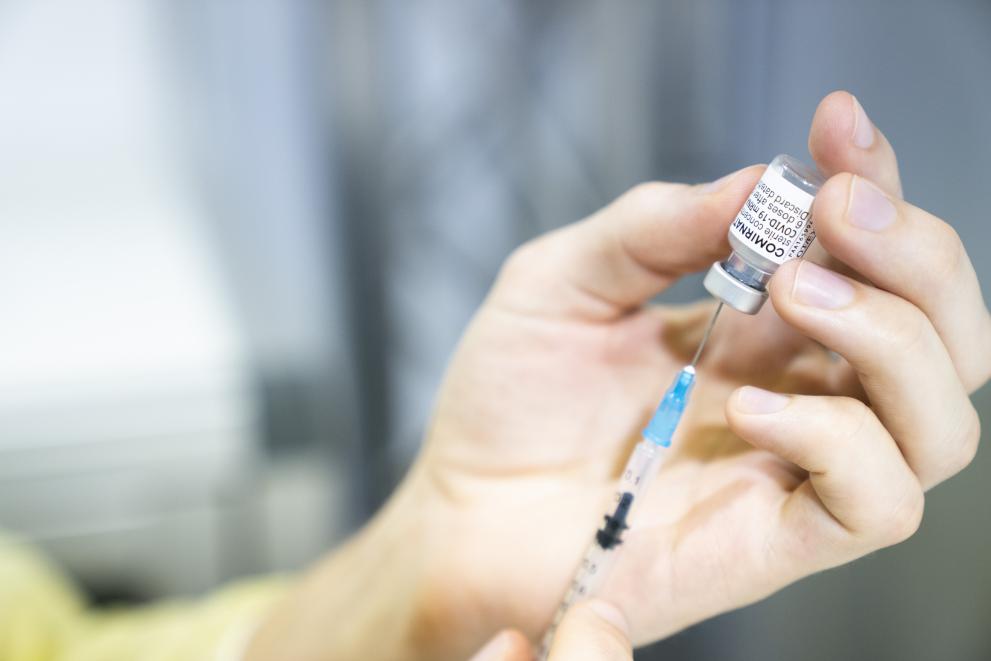
Die Europäische Arzneimittel-Behörde (EMA) hat heute (Donnerstag) empfohlen, die Zulassung für den COVID-19-Impfstoff Comirnaty von BioNTech/Pfizer in der EU um die Verwendung bei Kindern im Alter von fünf bis elf Jahren zu erweitern. Für die Anwendung bei Erwachsenen und Kindern ab zwölf Jahren ist Comirnaty bereits zugelassen. Bei den jüngeren Kindern ist die benötigte Dosis niedriger als bei Personen ab zwölf Jahren (10 µg gegenüber 30 µg). Die Europäische Kommission wird über die Empfehlung der EMA nun schnellstmöglich entscheiden.
Der Ausschuss für Humanarzneimittel (CHMP) der EMA kam zu dem Schluss, dass der Nutzen von Comirnaty bei Kindern im Alter von fünf bis elf Jahren die Risiken überwiegt, insbesondere bei Kindern mit Erkrankungen, die das Risiko eines schweren COVID-19-Verlaufs erhöhen. Wie bei der älteren Altersgruppe wird die Impfung in Form von zwei Injektionen in die Oberarmmuskulatur im Abstand von drei Wochen verabreicht.
Eine Hauptstudie an Kindern im Alter von fünf bis elf Jahren hatte zuvor gezeigt, dass die Immunreaktion auf Comirnaty in einer niedrigeren Dosis in dieser Altersgruppe mit der höheren Dosis bei 16- bis 25-Jährigen vergleichbar war (gemessen an der Menge der Antikörper gegen SARS-CoV-2). Die Wirksamkeit von Comirnaty wurde bei fast 2.000 Kindern im Alter von fünf bis elf Jahren berechnet, die keine Anzeichen einer früheren Infektion aufwiesen. Diese Kinder erhielten entweder den Impfstoff oder ein Placebo (eine Scheininjektion). Von den 1.305 Kindern, die den Impfstoff erhielten, erkrankten drei an COVID-19, während es bei den 663 Kindern, die das Placebo erhielten, 16 waren.
Die häufigsten Nebenwirkungen bei Kindern im Alter von fünf bis elf Jahren sind ähnlich wie bei Personen ab zwölf Jahren. Dazu gehören Schmerzen an der Injektionsstelle, Müdigkeit, Kopfschmerzen, Rötung und Schwellung an der Injektionsstelle, Muskelschmerzen und Schüttelfrost. Diese Wirkungen sind in der Regel leicht oder mäßig ausgeprägt und bessern sich innerhalb weniger Tage nach der Impfung.
Die Sicherheit und Wirksamkeit des Impfstoffs sowohl bei Kindern als auch bei Erwachsenen wird weiterhin genau überwacht, sowohl während seines Einsatzes in den Impfkampagnen in den EU-Mitgliedstaaten durch das EU-Pharmakovigilanzsystem also auch durch laufende und zusätzliche Studien des Unternehmens und der europäischen Behörden.
Weitere Informationen:
Pressmeldung der EMA (Englisch): Comirnaty COVID-19 vaccine: EMA recommends approval for children aged 5 to 11
Pressekontakte bei der EMA: EMA-Pressestelle, Tel. +31 (0)88 781 8427
Pressekontakt Kommissionsvertretung: Claudia Guske, Tel.: +49 (30) 2280-2190. Mehr Informationen zu allen Pressekontakten hier.
Anfragen von Bürgerinnen und Bürgern beantwortet das Team des Besucherzentrums ERLEBNIS EUROPA per E-Mail oder telefonisch unter (030) 2280 2900.
Einzelheiten
- Datum der Veröffentlichung
- 25. November 2021
- Autor
- Vertretung in Deutschland
